L'oxydation libre se produit avec la participation de formes radicalaires libres de l'oxygène, qui se forment lors du processus de réduction d'un électron de l'oxygène et, surtout, anion superoxyde oxygène.
Typiquement, ces réactions d'oxydation radicalaire se produisent dans le centre actif des enzymes correspondantes et les produits intermédiaires n'apparaissent pas dans l'environnement extérieur. Lorsque les conditions de fonctionnement de la chaîne respiratoire changent (par exemple lors d'une hypoxie), une réduction d'un électron de l'oxygène y est également possible, du fait que son affinité pour l'ubiquinone est supérieure à celle pour la cytochrome oxydase. Ces processus conduisent à la formation d’anions superoxydes d’oxygène. Ce radical peut également se former sous l'influence des rayons ultraviolets, ainsi que par l'interaction de l'oxygène avec des ions métalliques de valence variable (le plus souvent avec le fer) ou lors de l'oxydation spontanée de certains composés, comme la dopamine. Enfin, il peut être produit dans les cellules par des enzymes telles que la xanthine oxydase ou la NADPH oxydase.
La formation d’anions superoxydes d’oxygène a une signification biologique importante. C'est un composé hautement réactif qui, en raison de sa forte hydrophilie, ne peut pas quitter la cellule et s'accumule dans le cytoplasme. Ses transformations conduisent à la formation d'un certain nombre d'agents oxydants actifs (Fig. 9.10). Il est capable d'activer la NO synthase, qui forme un radical NO dans les tissus, qui possède les propriétés d'un second messager (active la guanylate cyclase soluble dont le produit, le GMPc, présente des propriétés vasodilatatrices). D'autre part, l'anion superoxyde est capable de réduire la teneur en radical NO, le convertissant en peroxynitrite ONOOH (voir Fig. 9.10).
Les cellules vivantes disposent de systèmes de défense contre la production accrue de radicaux libres. Enzyme superoxyde dismutase convertit l'anion superoxyde de l'oxygène en peroxyde d'hydrogène H, moins réactif et plus hydrophobe2À PROPOS2. Le peroxyde d'hydrogène est un substrat pour les peroxydases catalase et glutathion-dépendantes, qui catalysent sa conversion en molécule d'eau. Cependant, le peroxyde d’hydrogène peut générer un radical hydroxyle en présence de fer ferreux ou être converti en anion hypochlorite OCl par l’enzyme myéloperoxydase.
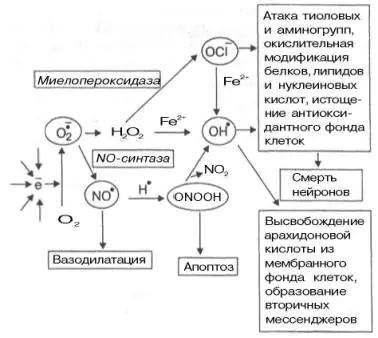
Riz. 9.10. Interconversions des radicaux libres et leurs principales fonctions dans les tissus [Boldyrev A.A., 1996].
L’anion hypochlorite et le radical hydroxyle sont tous deux des agents oxydants puissants. Ils sont capables de modifier les protéines, les acides nucléiques, d'induire une peroxydation lipidique (dont les lipides membranaires polyinsaturés « souffrent » le plus) et, à la suite de réactions en chaîne, de conduire à de multiples lésions membranaires et à la mort cellulaire. Un ajout important à ces réactions est la capacité du radical NO, lorsqu'il interagit avec l'anion superoxyde, à former du peroxynitrite, qui peut induire ce qu'on appelle l'apoptose (mort cellulaire programmée) et, lors de sa décomposition spontanée, se transformer en radical hydroxyle. Ce dernier peut également être formé à partir d’anion hypochlorite en présence d’ions fer.
Les processus se produisant avant la formation de l'anion hypochlorite ou du radical hydroxyle sont localisés dans le cytoplasme et contrôlés par des enzymes cytoplasmiques ou des antioxydants naturels solubles dans l'eau. Par exemple, taurine capable de lier l'anion hypochlorite sous la forme d'un complexe chloramine, un dipeptide carnosine et ses dérivés neutralisent le radical hydroxyle, et des composés tels que les protéines ferritine, lier le fer. La peroxydation lipidique, initiée dans l'espace hydrophobe des membranes cellulaires, est capable d'interrompre l'antioxydant hydrophobe bien connu. α-tocophérol (vitamine E). Sa forte concentration dans les membranes biologiques les empêche d'être endommagées par les radicaux libres.
La suppression complète des processus peroxydes dans les tissus est apparemment peu pratique ; les radicaux libres ont des propriétés bénéfiques. Ils induisent l'apoptose et participent à la formation de l'immunité cellulaire. La formation d'hydroperoxydes des chaînes d'acides gras des phospholipides polyinsaturés endommage la bicouche et, en stimulant le travail des phospholipases, favorise la libération d'acides gras des lipides membranaires. L’acide arachidonique polyinsaturé est une cible courante des attaques des radicaux libres. Ce processus peut stimuler ses transformations enzymatiques de deux manières : lipoxygénase ou cyclooxygénase. En conséquence, d'importants régulateurs biologiques se forment dans la cellule : prostaglandines, leucotriènes, thromboxanes. Les lysophospholipides formés lors du clivage d'un acide gras modifié peuvent être restaurés à leur état d'origine à l'aide d'un autre acide gras (sous forme d'acyl-CoA). De cette manière, la composition en acides gras des molécules lipidiques de la membrane cellulaire peut être régulée.
Les radicaux libres d'oxygène hautement réactifs, caractérisés par un potentiel d'oxydation élevé et la capacité de subir des transformations rapides, peuvent induire des réactions en chaîne. Actuellement, le rôle important des processus radicaux libres dans le développement d'états tissulaires et pathologiques liés à l'âge est reconnu [Vladimirov Yu.A. et al., 1983]. Les transformations des radicaux libres sont impliquées dans des mécanismes qui augmentent la survie cellulaire dans des conditions défavorables, et une diminution de la génération de radicaux libres dans l'organisme contribue à l'affaiblissement de l'immunité cellulaire. Cependant, une génération accrue de radicaux libres accompagne des conditions pathologiques (maladie de Parkinson, maladie d'Alzheimer) et le processus de vieillissement biologique lui-même.
NIVEAU DE GÉNÉRATION DE RADICAUX LIBRES DANS LES ÉCHANTILLONS D'ÉJACULAT DE PATIENTS INFERTILITÉ
Le niveau de génération de radicaux libres dans les échantillons d'éjaculat de patients infertiles a été évalué à l'aide de la méthode de chimiluminescence. Il a été démontré que dans les échantillons contenant des anticorps anti-spermatozoïdes, le risque de lésion de la membrane plasmique des spermatozoïdes augmente en raison de la génération excessive de radicaux libres. Une grande attention est accordée à l'étude du rôle des anticorps anti-spermatozoïdes (ASAT) dans le processus de reproduction. Cependant, la question de l’effet de l’ACAT sur la fécondation reste encore floue. Les travaux de certains auteurs révèlent une relation entre la présence d'anticorps et une diminution du risque de grossesse, tandis que dans d'autres études l'influence de l'ACAT sur la diminution de cet indicateur chez les patientes présentant des anticorps est remise en question. Le but de ce travail était d’évaluer le niveau de génération de SR dans des échantillons d’éjaculat ACAT-positifs et ACAT-négatifs.
Publication : Bulletin de biologie expérimentale et de médecine
Année de publication : 2001
Volume : 3s.
Informations complémentaires : 2001.-N 6.-P.658-660
Vues : 171
Espèces réactives de l'oxygène (ROS) – les composés dans lesquels l'oxygène possède un électron non apparié.
Les ROS se forment lorsque les conditions de fonctionnement de la chaîne respiratoire changent (par exemple lors d'une hypoxie), sous l'influence des rayons UV, lors de l'interaction de l'oxygène avec des ions métalliques à valence variable (fer), lors de l'oxydation spontanée de certaines substances, avec la participation des enzymes xanthine oxydase ou NADPH oxydase. Dans ces conditions, il se forme anion superoxyde oxygène O2 .− , alors peroxyde d'hydrogène H2À PROPOS2 Et radical hydroxyde HO. . Ils provoquent des espèces réactives de l'oxygène peroxydation lipidique - un processus conduisant à de graves lésions membranaires, endommageant les protéines et l'ADN.
L'inactivation des espèces réactives de l'oxygène dans les cellules se produit sous l'action du système antioxydant. Il comprend plusieurs enzymes antioxydantes et des antioxydants de bas poids moléculaire (vitamine C, glutathion, vitamine E, etc.).
Superoxyde dismutase(SOD) convertit l'anion superoxyde de l'oxygène en peroxyde d'hydrogène H2À PROPOS2:
Catalase - l'enzyme hémine contenant Fe 3+ catalyse la réaction de décomposition du peroxyde d'hydrogène. Cela produit de l'eau et de l'oxygène :
L'activité la plus élevée de la catalase dans le corps est caractéristique du foie. Il y a beaucoup de catalase dans les érythrocytes. Là, il protège l'hème de l'hémoglobine de l'oxydation.
Peroxydase- enzyme hème, réduit le peroxyde d'hydrogène en eau ; Dans le même temps, une autre substance est oxydée :
La peroxydase est capable de décomposer d'autres peroxydes et de les convertir en alcools. L'activité peroxydase se retrouve dans le foie, les reins et les leucocytes neutrophiles.
Antioxydants - des substances biologiquement actives qui interagissent avec les radicaux libres et empêchent les processus d'oxydation radicalaire des substances organiques dans l'organisme.
vitamines,présentant des propriétés antioxydantes - S, E, A, R. Le tripeptide présente des propriétés antioxydantes glutathion, taurine (acide 2-aminoéthanesulfonique), dipeptide carnosine
La suppression complète des processus peroxydés dans les tissus est apparemment peu pratique. Les radicaux libres induisent apoptose, participez à la formation l'immunité cellulaire, stimuler le travail des phospholipases, participant ainsi à la synthèse des eicosanoïdes.
Cependant, une génération accrue de radicaux libres accompagne des conditions pathologiques (maladie de Parkinson, maladie d'Alzheimer) et le processus de vieillissement biologique lui-même.
Date d'ajout : 2015-03-19 ; vues : 759 ; COMMANDER UNE ÉCRITURE D'ŒUVRE



